
数字で見るドラッグ・ラグ、ドラッグ・ロス


医薬品の研究開発は、多くの時間と労力、そして資金が注ぎ込まれる領域です。先発の医療用医薬品として知られる「新薬」は、その有効性や安全性を検証するための研究開発、そして国からの承認を取得するまでに計9〜16年※1もの長い歳月と数百億〜1,000億円※2もの膨大な費用がかかると言われています。そのうえ新薬として世にでる成功確率が約2万5,000分の1※3と言われることからも新薬開発の難しさが伺えます。
なお、先発医薬品の特許期間満了後に、先発医薬品と同じ有効成分である後発医薬品、すなわち「ジェネリック」が市場に登場します。後発医薬品は、先発医薬品に比べ開発費用がかからないため一般的に4〜7割※4安価に提供されます。その他にも、一般用医薬品(OTC;Over The Counterの略)として知られる薬があり、これはドラッグストア薬局などで処方せん無しで手に入る医薬品を指します。
このような背景を持つ医薬品の中で、先発医薬品、すなわち新薬で起こっている「ドラッグ・ラグ」や「ドラッグ・ロス」という問題について、本記事で詳しく解説していきます。
※1、3:「製薬協ガイド 2023」https://www.jpma.or.jp/news_room/issue/guide/lofurc0000002wh8-att/JPMA_guide2023_0711_low.pdf
※2:「中央社会保険医療協議会 薬価専門部会(第 182 回) 議事次第」https://www.mhlw.go.jp/content/12404000/000852314.pdf
※4:「令和6年度薬価改定について ④」
https://www.mhlw.go.jp/content/12404000/001129375.pdf
ドラッグ・ラグ、ドラッグ・ロスとは
「ドラッグ・ラグ」とは、海外で使われている医薬品が日本で承認されて使えるようになるまでの時間差のことをいいます。一方、「ドラッグ・ロス」とは海外ですでに使われている医薬品の開発が日本で行われず、使うことができない状況をいいます。
では、なぜこのような状況が発生しているのでしょうか?日本のドラッグ・ラグやドラッグ・ロスの現状やその要因について、実際の数値データを基に解説していきます。ドラッグ・ラグおよびドラッグ・ロスの現状
次に日本のドラッグ・ラグやドラッグ・ロスの現状を、数値データを基に見ていきましょう。
①日本国内での医薬品の未承認率「72%」
②日本国内未承認薬の未開発率「69%」
③日本と欧州での承認率の差 「16%・19%・11%」
④取り上げ記事数「458件」①日本国内での医薬品の未承認率「72%」

こちらのグラフは2016年から2020年までの間に欧米で承認された医薬品のうち、日本国内で承認されていない医薬品数とその割合を表したものです。2016年までの直近5年間には208品目のうち56%に当たる117品目が国内で未承認の医薬品(未承認薬)でしたが、2020年までの直近5年間には243品目中176項目となり、未承認薬の割合が72%にまで増加しています。つまり「72%」は、2020年までの直近5年間に欧米で承認された医薬品のうち、日本国内で承認されていない医薬品の割合です。
参考:「ドラッグ・ラグ:国内未承認薬の状況とその特徴」
https://www.jpma.or.jp/opir/news/063/08.html②日本国内未承認薬の未開発率「69%」
欧米で承認されているにもかかわらず、日本国内では承認されていない、医薬品が多くあることがわかりました。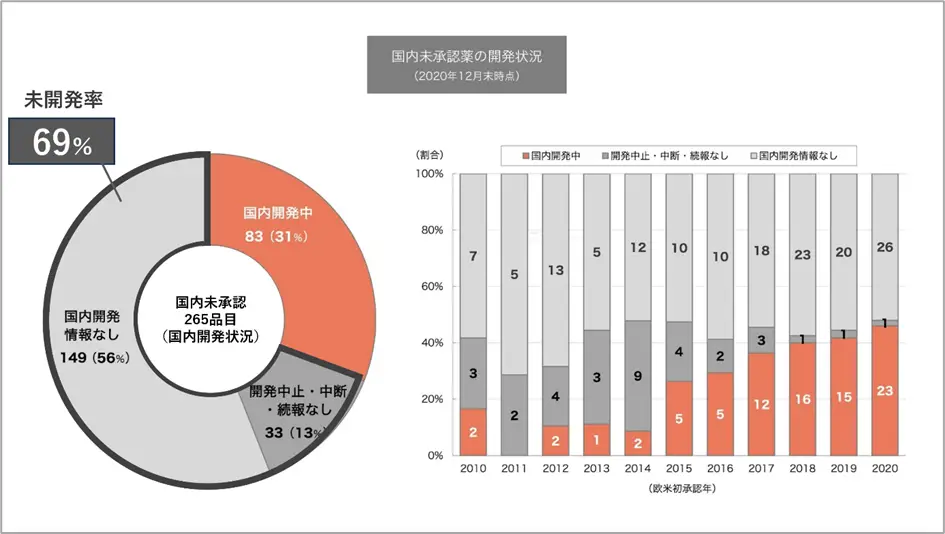
上記のグラフは国内未承認薬の国内開発状況を表しています。左側の円グラフは、2010年から2020年の間に日米欧で初めて承認された医薬品のうち、2020年12月末時点で国内未承認であった265品目の内訳です。265品目中83品目は国内で開発が進んでいる医薬品ですが、残りの182品目は国内での開発が進んでいない医薬品の数にあたり、この割合が「69%」です。
また、右側の棒グラフは、それらの医薬品が欧米で初めて承認された年の日本での開発状況です。年を追うごとに国内で開発中の医薬品の割合が増えていますが、それでも50%を下回るような現状であり、海外で承認されても国内では開発が進まない状況が続いています。
参考:「ドラッグ・ラグ:国内未承認薬の状況とその特徴」
https://www.jpma.or.jp/opir/news/063/08.html③日本と欧州での承認率の差 「16%・19%・11%」
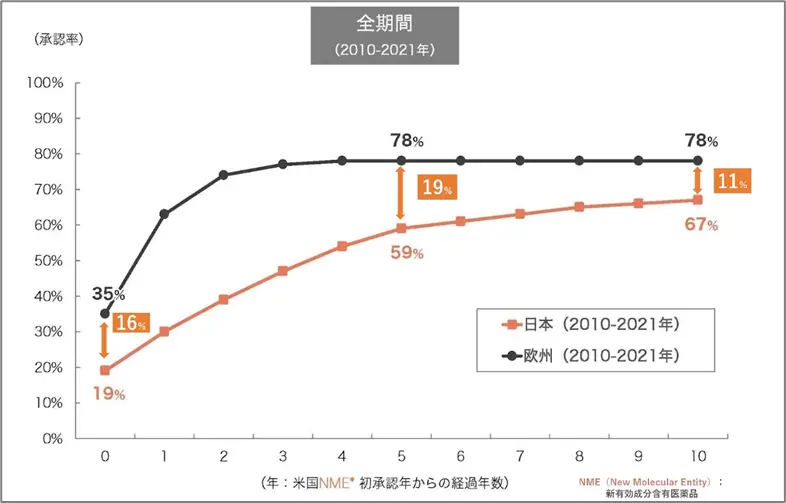
上記グラフの1番左側(横軸で0)を見ると、米国と同じ年に欧州で承認された品目の割合が35%であるのに対し、日本で承認された品目の割合は19%と、「16%」の差があります。次に米国で承認されてから5年後を見ると、欧州では78%の品目が承認されているのに対し、日本では59%しか承認されておらず、差が「19%」にまで広がっています。10年後では、欧州は5年後の割合と変わらず78%ですが、日本は6年目以降も割合は上がり67%です。欧州との承認率の差は「11%」にまで縮まりはしましたが、10年経っても承認率に1割以上の差があるのです。
このように、「16%・19%・11%」とは米国で承認された医薬品の日本と欧州での承認率の差を表しています。また、欧州では5年後の時点で曲線が漸近する高さになっています。これは欧州の方が日本よりも早期の承認率が高いことを表しています 。
参考:「ドラッグ・ラグ:日本と欧州の未承認薬状況の比較」
https://www.jpma.or.jp/opir/news/067/02.html④取り上げ記事数「458件」
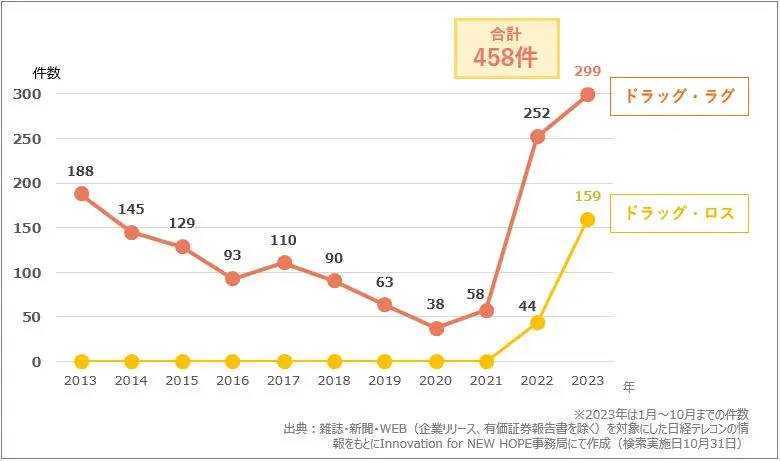
上記のグラフを見てください。こちらは「ドラッグ・ラグ」、「ドラッグ・ロス」に関する記事件数の推移を表したグラフです。2013年にはドラッグ・ラグに関する記事が188件でしたが、2021年から増加し始め、2023年には299件のドラッグ・ラグに関する記事がありました。ドラッグ・ロスに関する記事は今まで0件だったのが2022年には記事の中でワードとして登場し、2023年にはドラッグ・ロスの記事は159件で、ドラッグ・ラグとドラッグ・ロス合計して「458件」になり注目を集め始めています。
ドラッグ・ラグ、ドラッグ・ロスが起こる要因
では、ドラッグ・ラグやドラッグ・ロスは何が原因で起きているのでしょうか?様々な問題が複雑に絡み合っているのが実情ですが、ここでは「日本固有の規制」と「薬価」の観点で解説します。
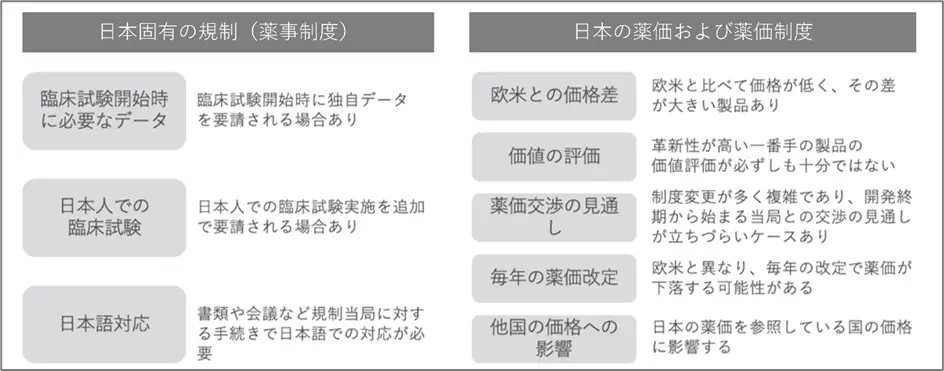
■日本固有の規制(薬事制度)による要因
日本での新薬の開発・承認プロセスは、規制当局が独自データの提出を求めたり、日本人特有の反応を確認する臨床試験を要求したりするために遅れることがあります。さらに、日本語での書類作成やコミュニケーションの必要性もプロセスを遅らせる要因となっています。
■薬価による要因
アメリカなどの諸外国は自由価格制度により製薬企業が薬価を設定できるのに対し、日本の製薬企業には薬価の決定権がありません。日本では多くの場合、改定により薬価が下がるため、製薬企業の利益を圧迫し、新薬の研究開発が難しくなるという問題が生じています。また、これまでは薬価の改定は2年に1度でしたが、現在では中間年改定により毎年薬価の改定が行われています。2年に1度の改定だった時期は薬価の年平均下落率は-2.4%でしたが、毎年の改定になってからの年平均下落率は-5.0%です。このような下落により日本で特許期間中でも薬価が下がると、日本の薬価を参照する他国でも薬価が低くなり、グローバル展開する企業では「日本では販売しない」、もしくは「日本での販売を遅らせる」といった判断をする可能性もあります。他にも医療制度の違いは国により様々ですが、特に欧米と比べて薬価が低く、その差が大きい製品があるのも事実です。
参考:「日本の患者さんと日本経済のための薬価制度の改善に向けて」https://www.mhlw.go.jp/content/10807000/000992274.pdf
上記2つの要因をまとめたのが下記表です。このような背景から、日本では新薬の開発や承認が他の国よりも時間がかかる傾向があり、ドラッグ・ラグやドラッグ・ロスの問題が生じています。
ドラッグ・ラグ、ドラッグ・ロスによって被るデメリット
最後にドラッグ・ラグ、ドラッグ・ロスがもたらすデメリットを確認しましょう。最も大きなデメリットは、海外には新しい医薬品があるのに、日本では承認されておらず、日本の患者さんがそれを日本で使用する機会を逸してしまうことです。つまり、治療の選択肢が限られ、新しい医療技術や知見を享受できないというリスクが高まります。現在、細胞医療や遺伝子治療など最先端の科学技術を用いた治療法の研究開発も行われていますが、こういった治療法でもドラッグ・ラグやドラッグ・ロスは起きています。
実際、日本から海外に渡航して治療を受ける事例も存在します。
歌手で俳優の西郷輝彦さんは、2011年に前立腺がんの診断を受けました。
海外では、前立腺がんの治療の際に使われる「PSMA標的治療薬」※という薬がありますが、これは日本では認可が下りていないため、西郷さんはオーストラリアに渡航して、この薬を用いる治療を受けることを余儀なくされました。2022年に75歳で亡くなった西郷さんですが、この経験から、「国内で認可が下りなくて、高額にはなるがやむを得ず海外で治療した経験等を多くの方に伝えたい」と語っていました。
※PSMA標的治療は、日本でも治験が進められていますが、2024年1月現在でまだ認可されていません。
ドラッグ・ラグ、ドラッグ・ロス解決に向けた取り組み
日本におけるドラッグ・ラグやドラッグ・ロスの問題への対応として、国は「経済財政運営と改革の基本方針2023(骨太方針2023)」で課題解決に向けた創薬力強化のために、以下の方針(一部抜粋)を打ち出しました。
・イノベーションの適切な評価などの更なる薬価上の措置
・情報基盤の整備や患者への還元等の解析結果の利活用に係る体制整備
・スタートアップ支援
・臨床開発、薬事規制調和に向けたアジア拠点の強化
・国際共同治験に参加するための日本人データの要否の整理
・未承認薬の解消に向けた薬事上の措置と承認審査体制の強化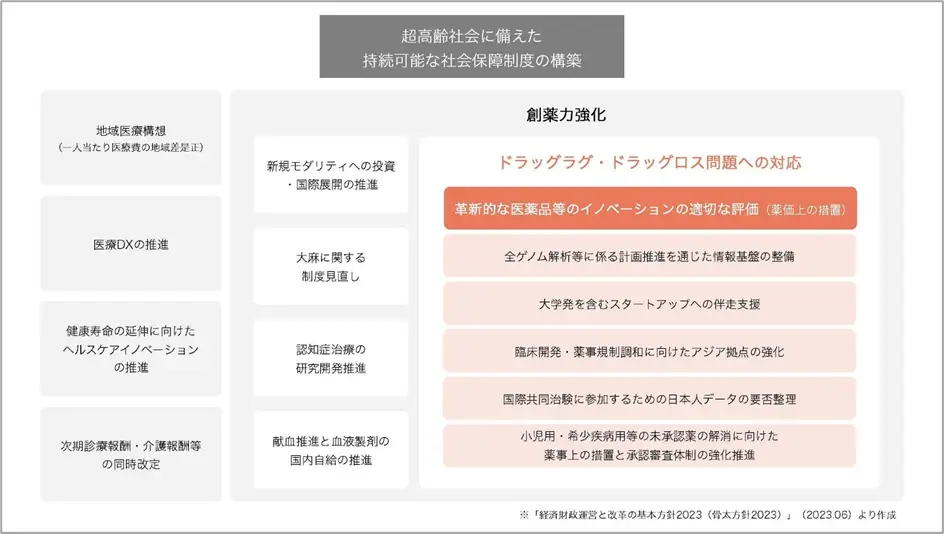 参考:「経済財政運営と改革の基本方針 2023」
参考:「経済財政運営と改革の基本方針 2023」
https://www5.cao.go.jp/keizai-shimon/kaigi/cabinet/honebuto/2023/2023_basicpolicies_ja.pdfまとめ
本記事では、ドラッグ・ラグとドラッグ・ロスの現状を数字で見ながら、その要因、そして解決のための取り組みについて紹介しました。欧米での新薬の承認から日本の患者さんがその恩恵を受けるまでの時間差や、時間差どころかその医薬品を日本で使える目途すら立たないという状況が起こっています。
Innovation for NEW HOPEプロジェクトは、このような社会課題解決のために多くの方々の理解を深め、「日本で最先端の治療法が1日でも早く、継続して届く社会」の実現を目指し最先端の治療法に関わる情報を今後も発信していきます。
よろしければSNS等で大切な方にご共有いただけると嬉しいです!
公式Xアカウントもぜひフォローください!






